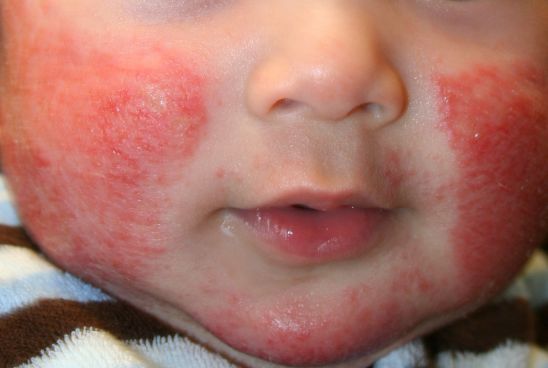
礼来(Eli Lilly)与合作伙伴Incyte近日宣布,欧盟委员会(EC)已批准口服JAK抑制剂Olumiant(baricitinib)一个新的适应症:用于治疗适合系统治疗的中度至重度特应性皮炎(AD)成人患者。
此次新适应症批准,基于Olumiant治疗AD的3期BREEZE-AD临床开发项目的数据,包括:(1)Olumiant治疗中重度AD患者的2项单药研究BREEZE-AD1和BREEZE-AD2;(2)Olumiant联合局部皮质类固醇治疗对环孢素无效、不耐受或有禁忌症的中重度AD患者的联合研究BREEZE-AD4;(3)Olumiant联合局部皮质类固醇治疗中重度AD患者的联合研究BREEZE-AD7。
所有研究均达到了主要终点:作为单药疗法以及联合标准护理局部皮质类固醇时,与安慰剂相比,Olumiant显著改善了疾病严重程度、有更高比例的患者皮损完全清除。
Olumiant是获得监管批准治疗AD的第一个JAK抑制剂,同时也是治疗AD的第一个口服药物。而且Olumiant的活性药物成分为baricitinib,该药是一种每日口服一次的选择性、可逆性JAK1和JAK2抑制剂,目前处于临床开发,用于多种炎症性疾病和自身免疫性疾病的治疗,包括类风湿性关节炎(RA)、银屑病、糖尿病肾病、特应性皮炎、系统性红斑狼疮等。JAK酶有4种,分别为JAK1、JAK2、JAK3和TYK2。JAK-依赖性细胞因子参与多种炎症和自身免疫性疾病的发病过程,提示JAK抑制剂或可广泛用于治疗各种炎症性疾病。在激酶检测试验中,baricitinib针对JAK1和JAK2表现出的抑制强度要比JAK3高出100倍。
礼来与Incyte于2009年达成独家合作协议,共同开发Olumiant及一些后续化合物。截至目前,Olumiant已获全球60多个国家(包括美国、欧盟和日本)批准,作为一种单药或联合甲氨蝶呤,用于对一种或多种疾病修饰抗风湿药物(DMARD)缓解不足或不耐受的中度至重度活动性类风湿性关节炎(RA)成人患者的治疗。在临床研究中,与标准护理疗法(例如甲氨蝶呤单药疗法,阿达木单抗联合背景甲氨蝶呤疗法)相比,Oluminant使RA症状和体征实现显著改善。
治疗RA方面,Olumiant在欧盟批准的剂量为4mg和2mg,在美国批准的剂量为2mg。用药方面,Olumiant每日口服一次,可作为单药或联合甲氨蝶呤(MTX)或其他非生物疾病修饰抗风湿疗法(non-biologic DMARDs)。不推荐将Olumiant与其他JAK抑制剂、或生物DMARD、强效免疫抑制剂(如硫唑嘌呤和环孢菌素)联合用药。值得注意的是,Olumiant的美国药物标签中附有一则黑框警告,提示严重感染、恶性肿瘤和血栓形成的风险。
(责任编辑:香港祺昌药业)
联系祺昌
24小时服务热线:(086)198 9653 1862 / (086)189 2841 1962