【Enhertu(DS8201)简述】
美国食品与药品总局FDA批准了Enhertu(fam-trastuzumab deruxtecan-nxki)用于两个或多个先前基于抗HER2的治疗方案后的HER2阳性不可切除或转移性乳腺癌。
Enhertu是一种针对HER2的抗体-药物偶联物(ADC),FDA的批准基于184例HER2阳性转移性乳腺癌女性患者Enhertu(5.4mg/kg)单药的II期注册临床试验DESTINY-Breast01的结果癌症。所有患者均接受过曲妥珠单抗,ado-曲妥珠单抗坦坦碱治疗,其中66%的患者曾接受过帕妥珠单抗治疗。

【Enhertu(DS8201)作用机制】
II期试验结果显示,确认的客观缓解率为60.3%(n =111; 95%CI:52.9-67.4),包括4.3%的完全缓解率(n=8)和56.0%的局部缓解率(n=103)。截至2019年8月1日,中位反应持续时间为14.8个月(95%CI:13.8-16.9)。此外,基于无进展生存的中位时间为16.4个月(95%CI:12.7,不可估计)。中位随访时间为11.1个月,最近在圣安东尼奥乳腺癌研讨会上发表,并在线发表在《新英格兰医学杂志》上。
【Enhertu(DS8201)适应症和用法】
适用于治疗患有不可切除或转移性HER2阳性乳腺癌的成年患者,这些患者已在转移环境中接受了两种或更多种基于抗HER2的先前治疗方案。
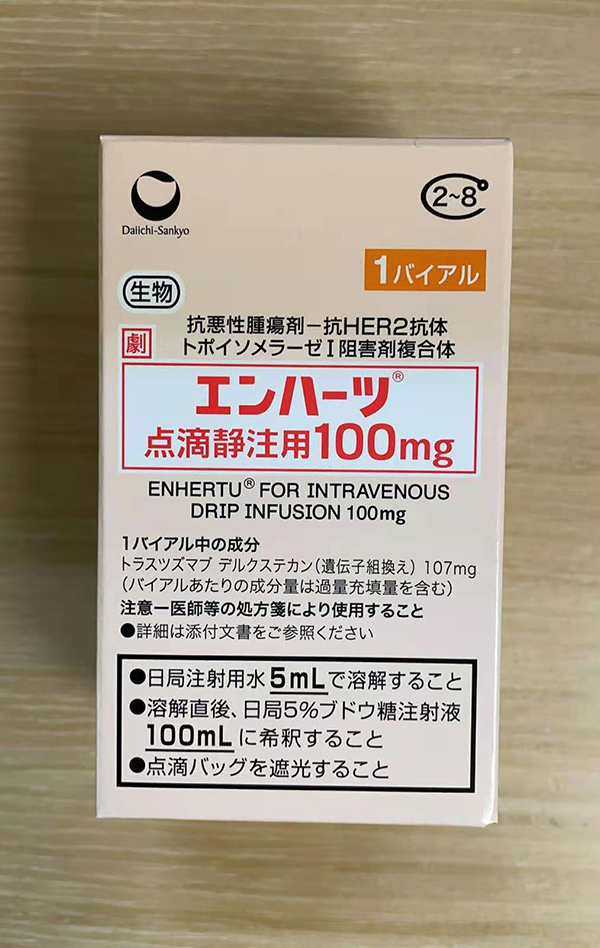
【Enhertu(DS8201)剂量及给药】
本品为针剂,静脉滴注用,每瓶含有效成份100mg。
需用5ml注射用水溶解,并用5%葡萄糖注射液100ml稀释,对患者进行滴注。
【Enhertu(DS8201)禁忌症】
没有。
【Enhertu(DS8201)警告和注意事项】
Enhertu已获得盒装警告,可治疗间质性肺疾病(ILD)/肺炎和胚胎-胎儿毒性。在总共234名接受了至少一剂Enhertu剂量的HER2阳性的不可切除或转移性乳腺癌患者中,通过II期试验DESTINY-Breast01和早期I期试验的汇总分析,评估了Enhertu的安全性。5.4mg/kg)。9%的患者发生ILD。在2.6%的患者中,由于ILD和/或肺炎引起的致命结果发生-先前在第一阶段试验中报告的两例死亡和先前在第二阶段试验中的DESTINY-Breast01报告的四例死亡。患者和医生应注意ILD /肺炎,应积极监测患者的潜在体征和症状。如果发现ILD /肺炎,应按照FDA批准的美国处方信息进行管理。管理可能需要调整剂量或中止治疗和类固醇治疗。
【Enhertu(DS8201)不良反应】
最常见的不良反应(频率≥20%)为恶心,疲劳,呕吐,脱发,便秘,食欲下降,贫血,中性粒细胞减少,腹泻,白细胞减少,咳嗽和血小板减少。
【Enhertu(DS8201)药物相互作用】
【Enhertu(DS8201)用于特定人群】
Enhertu报道了间质性肺疾病(ILD)和肺炎,包括致命病例。监测并及时调查体征和症状,包括咳嗽,呼吸困难,发烧以及其他新的或恶化的呼吸道症状。在所有2级以上ILD /肺炎患者中永久停用Enhertu。告知患者危险,并立即报告症状。
怀孕期间暴露于Enhertu可能导致胚胎胎儿伤害。告知患者这些风险以及有效避孕的必要性。
【Enhertu(DS8201)包装提供/存储和处理】
(责任编辑:香港祺昌药业)
联系祺昌
24小时服务热线:(086)150 1799 1962 / (086)189 2841 1962



