TG Therapeutics公司近日宣布,美国食品和药物管理局(FDA)已授予ublituximab与umbralisib组合疗法(U2)快速通道资格(FTD),用于治疗慢性淋巴细胞白血病(CLL)成人患者。快速通道资格(FTD)旨在加速针对严重疾病的药物开发和快速审查。
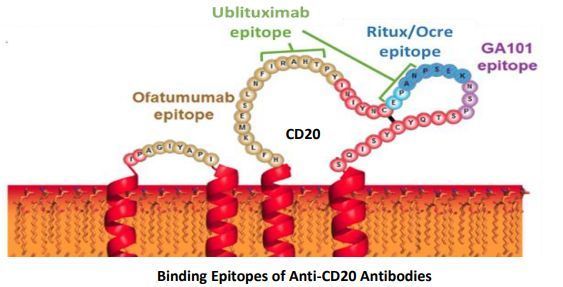
ublituximab则是一种新型糖工程化抗CD20单克隆抗体,靶向成熟B淋巴细胞上CD20抗原的一个独特表位。umbralisib是一种口服、每日一次的、新一代PI3Kδ抑制剂,可独特地抑制CK1-ε,这可能使其克服第一代PI3Kδ抑制剂相关的某些耐受性问题。
如果获准上市,U2将为先前未接受过治疗(初治)的CLL患者、以及对先前疗法治疗无效或复发的CLL患者提供一种新的、无化疗方案。
FDA授予U2组合疗法FTD,是基于全球III期UNITY-CLL试验的阳性顶线结果。该试验在先前未接受治疗(初治)和复发/难治性(经治)慢性淋巴细胞白血病(CLL)患者中开展,评估了U2组合疗法的疗效和安全性,并与obinutuzumab+苯丁酸氮芥方案进行了对比。
该项试验是根据与FDA达成的特别方案评估(SPA)协议开展的。结果显示,该试验在预先指定的中期分析中已经达到了主要终点:根据独立审查委员会(IRC)的评估,与obinutuzumab+苯丁酸氮芥治疗组相比,U2治疗组无进展生存期(PFS)取得了统计学意义的显著改善(p<0.0001),在既往未接受治疗(初治)和复发/难治性(经治)CLL患者群体中均观察到了治疗益处。
根据该试验的数据,TG公司计划在2020年底之前提交U2方案治疗先前未接受治疗(初治)和复发/难治性(经治)CLL患者的监管申请。
(责任编辑:香港祺昌药业)
联系祺昌
24小时服务热线:(086)150 1799 1962 / (086)189 2841 1962