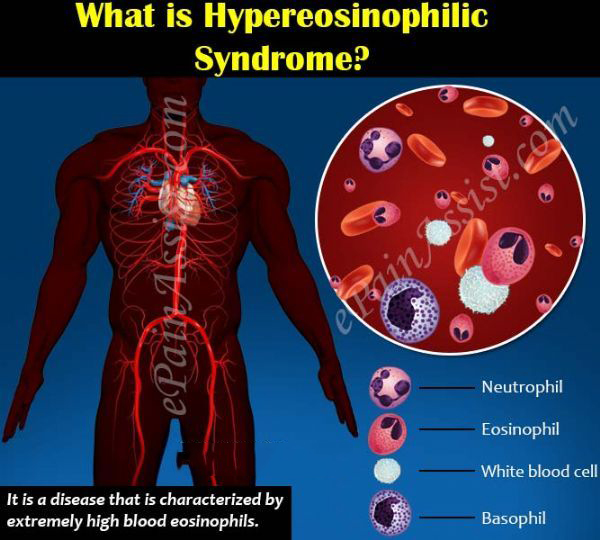
葛兰素史克(GSK)近日宣布,美国食品和药物管理局(FDA)已批准抗炎药Nucala(mepolizumab,美泊利单抗)一个新的适应症,用于治疗高嗜酸性粒细胞综合征(HES)患者,具体为:HES持续≥6个月、无可识别的非血液学次要原因、年龄≥12岁的成人和儿科患者。HES是一种罕见的、危及生命的、由嗜酸性炎症引起的疾病,治疗方案非常有限。
值得一提的是,Nucala是第一个也是唯一一个被批准用于治疗这种嗜酸性粒细胞驱动疾病的靶向生物疗法,将改变HES患者的治疗格局。而HES也是Eucala获批的第三个适应症,该药之前已被批准:作为一种附加维持疗法,用于治疗重度嗜酸性粒细胞性哮喘(SEA)、嗜酸粒细胞性肉芽肿性多血管炎(EGPA)。
此次批准,基于关键III期临床研究(NCT02836496)的阳性结果。这是一项随机、双盲、安慰剂对照、36周研究,评估了Nucala用于青少年和成人治疗重度HES的疗效和安全性。重度HES定义为:过去12个月内至少出现两次HES耀斑、血液嗜酸性粒细胞计数≥1000个细胞/微升。研究中,共有108例患者被随机分配,接受每四周一次皮下注射Nucala 300mg(3x100)或相匹配的安慰剂,同时继续接受其当前的HES疗法。研究的主要终点是32周治疗期间经历一次HES耀斑的患者比例,次要终点包括:发生首次HES耀斑的时间(定义为随机化开始至出现HES耀斑的时间)、治疗第20-32周期间经历一次HES耀斑的患者比例、HES耀斑年化率、根据简易疲劳量表(BFI)第三项评估的疲劳严重程度相对基线的变化。
结果显示,该研究达到了主要终点:联合标准护理治疗32周期间,与安慰剂组相比,Nucala治疗组发生一次HES耀斑的患者比例显著减少50%(56% vs 28%,p=0.002)。研究的次要终点也具有统计学意义,并支持主要终点结果,数据显示:治疗32周期间,与安慰剂组相比,Nucala治疗组发生首次HES耀斑的风险降低了66%(危险比[HR]=0.34,95%CI:0.18-0.67)、HES耀斑年化率降低了66%(发生率比值比[RR]=0.34,95%CI:0.19-0.63)、疲劳评分表现出改善(p=0.036)。该研究中的安全性结果与Nucala已知的安全性一致。
Nucala
Nucala被认为是通过降低血液中嗜酸性粒细胞水平而起作用的,有证据表明,该药有可能成为一系列由嗜酸性粒细胞增多引起的炎性疾病的靶向治疗选择。来自上述关键III期研究的数据非常令人鼓舞,为HES患者带来了希望。
24小时服务热线:(086)150 1799 1962 / (086)189 2841 1962
