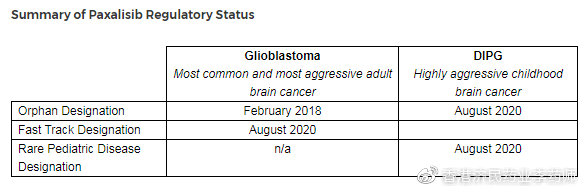
Kazia Therapeutics公司近日宣布,美国食品和药物管理局(FDA)已授予paxalisib(原GDC-0084)治疗胶质母细胞瘤(glioblastoma)的快速通道资格(FTD),具体为:新诊断的、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)基因启动子呈非甲基化状态、已完成初步放疗和替莫唑胺治疗的患者。在2018年2月,FDA还授予了paxalisib治疗胶质母细胞瘤的孤儿药资格(ODD)。
此外,在上周末,FDA还授予了paxalisib治疗恶性胶质瘤的孤儿药资格(ODD),包括DIPG。而在本月早些时候,FDA还授予了paxalisib治疗DIPG的罕见儿科疾病资格(RPDD)。DIPG是一种罕见和高度侵袭性的儿童恶性肿瘤,极度缺乏有效治疗手段、致死率极高。目前,paxalisib治疗DIPG的一项I期研究正在St Jude儿童研究医院进行,初步疗效数据预计2020年下半年获得。
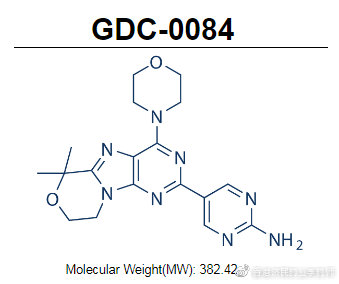
paxalisib是Kazia的先导候选药物,这是一种能穿过血脑屏障的PI3K/AKT/mTOR通路小分子抑制剂,于2016年底从罗氏旗下基因泰克获得授权,于2018年进入II期临床试验。
胶质母细胞瘤是原发性脑癌中最常见、最具侵袭性的一种类型。此次FTD的目标患者准确地反映了paxalisib正在进行的II期临床研究中所研究的患者群体,是GBM AGILE关键研究的主要建议人群,也是商业发布时的预期适应症。
胶质瘤
在美国,FTD的设立旨在加速针对严重疾病的药物开发和快速审查,以解决关键领域严重未获满足的临床医疗需求。paxalisib获得FTD,意味着有机会以各种形式的加快审评进程,包括在研发阶段可以与FDA进行更频繁的会晤与沟通;在满足相关标准的情况下,实行滚动式审评机制,即可分阶段递交新药申请(NDA)申报资料,而不需要待所有资料全部完成后再提交审评;FTD的授予也有望进一步获得优先审评和加速批准资格。
FDA授予paxalisib FTD,意味着该机构已认识到该药有潜力显著改善胶质母细胞瘤患者的预后,这是一个非常有力的认可。Kazia公司已计划在2021财年开始启动paxalisib新药申请(NDA)提交的准备事宜。
paxalisib-GDC-0084化学结构式
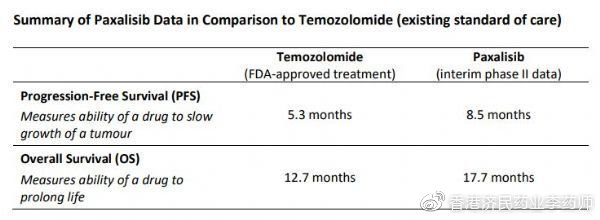
今年4月初,Kazia公司公布了正在进行的评估paxalisib治疗胶质母细胞瘤(GBM)II期研究(NCT03522298)的阳性中期数据。该研究在新诊断的、非甲基化MGMT启动子状态的GBM患者中开展,正在评估患者接受最大限度手术切除和替莫唑胺(temozolomide,TMZ)联合同步放化疗后,将paxalisib作为辅助治疗药物的安全性、耐受性、推荐的II期剂量(RP2D)、药代动力学(PK)和临床活性。TMZ是目前治疗GBM的标准护理疗法。
结果显示:
(1)paxalisib辅助治疗的中位总生存期(OS)为17.7个月,与现有标准护理TMZ相关的12.7个月相比,代表着临床意义的生命延长。
(2)paxalisib辅助治疗的中位无进展生存期(PFS)为8.5个月,与现有标准护理TMZ相关的5.3个月相比,代表着有利结果。
(3)接受治疗时间最长的患者,在确诊后19个月仍保持疾病无进展。
(4)大约一半的入组患者,仍然在接受paxalisib治疗,随着研究的继续推进,OS和PFS数据可能进一步改善。
该研究的进一步数据预计将在2020财年下半年公布,最终数据预计将在2021财年上半年公布。对于任何新的抗癌药物而言,“金标准”都是延长生命的能力——在胶质母细胞瘤(GBM)等疾病中,这是一个特别具有挑战性的目标。这些新数据提供了第一份临床证据,证明paxalisib有潜力在一个非常具有挑战性的患者群体中实现这一目标。
二十多年来,新诊断的胶质母细胞瘤患者没有任何新的药物治疗。paxalisib正在迅速成为这一极具挑战性疾病全球管线中最有希望的候选药物之一。
24小时服务热线:(086)150 1799 1962 / (086)189 2841 1962
