罗氏(Roche)近日宣布,欧盟委员会(EC)有条件批准靶向抗癌药恩曲替尼Rozlytrek(entrectinib),用于治疗12岁及以上神经营养性酪氨酸受体激酶(NTRK)基因融合阳性实体瘤儿科及成人患者,具体为:疾病局部进展、转移或手术切除可能导致严重患病、且先前没有接受过NTRK抑制剂、没有令人满意的治疗选择的患者。此外,EC还批准Rozlytrek,用于治疗先前没有接受过ROS1抑制剂的ROS1阳性、晚期非小细胞肺癌(NSCLC)成人患者。在美国,Rozlytrek于2019年8月获批上述2个适应症。
Rozlytrek是罗氏第一个肿瘤不可知论(tumor-agnostic,即与肿瘤类型无关,“不限癌种”)疗法,已在多种肿瘤类型中显示出持久缓解,包括已经扩散到大脑的肿瘤。在美国和欧盟,Rozlytrek之前分别被授予了治疗NTRK融合实体瘤的突破性药物资格(BTD)和优先药物资格(PRIME)。NTRK基因融合已经在一系列难以治疗的实体瘤类型中得到了鉴定,包括胰腺癌、甲状腺癌、唾液腺癌、乳腺癌、结直肠癌和肺癌。
欧盟批准Rozlytrek,基于多项临床研究的数据,包括关键性II期研究STARTRK-2、I期研究STARTRK-1、I期研究ALKA-372-001、以及在儿科患者中开展的I/II期研究STARTRK-NG。这些研究表明,Rozlytrek对多种NTRK基因融合阳性实体瘤(包括:肉瘤、非小细胞肺癌、唾液腺乳腺样分泌癌(MASC)、分泌性和非分泌性乳腺癌、甲状腺癌、结直肠癌、神经内分泌瘤、胰腺癌、卵巢癌、子宫内膜癌、胆管癌、胃肠道癌和神经母细胞瘤)和ROS1阳性NSCLC具有持久应答。综合分析结果如下:
——治疗NTRK融合阳性实体瘤:Rozlytrek的总缓解率(ORR,74例患者)为63.5%,在13种不同的实体瘤类型中均观察到客观缓解,中位缓解持续时间(DoR)为12.9个月(范围:9.3-未达到)。
——治疗ROS1阳性晚期NSCLC:Rozlytrek的总缓解率(ORR;94例患者,中位随访12个月)为73.4%,中位DoR为16.5个月(范围:14.6个月-28.6个月)。在161例随访6个月的患者中,包括29%的中枢神经系统(CNS)转移患者,ORR为67.1%。
——基线存在中枢神经系统(CNS)转移患者:均观察到对Rozlytrek的治疗反应,NTRK和ROS1患者群体中的颅内ORR分别为62.5%和79.2%。
——治疗儿科患者:Rozlytrek在全部NTRK基因融合(n=5)儿童和青少年患者中均缩小了肿瘤(ORR=100%)、其中2例获得完全缓解(CR=40%)。2例有原发性高级别肿瘤的患者中均观察到客观缓解,其中1例完全缓解。
Rozlytrek的耐受性良好,最常见的不良反应包括:疲劳、便秘、味觉改变(口臭)、肿胀(水肿)、头晕、腹泻、恶心、神经系统紊乱(感觉障碍)、呼吸短促(呼吸困难)、贫血、体重增加、血肌酐增加、疼痛、认知障碍、呕吐、咳嗽、发热。
Rozlytrek的批准,显示了将基因组检测分析与精准医学相结合为罕见和难以治疗的癌症患者提供个性化治疗选择的价值。基于基因组检测,Rozlytrek将为许多癌症中携带NTRK或ROS1基因融合的患者提供一种有效的一线疗法,包括已经发生脑转移的患者。
值得一提的是,Rozlytrek是批准上市的第三款基于不同类型肿瘤的共同生物标志物而不是肿瘤起源组织类型的“不限癌种”抗癌药。另外2款已获批“不限癌种”适应症的药物分别为:(1)默沙东抗PD-1疗法Keytruda(可瑞达,帕博利珠单抗),2017年获批治疗微卫星高不稳定性(MSI-H)或错配修复缺陷(dMMR)肿瘤、2020年6月获批治疗高肿瘤突变负担(TMB-H)实体瘤;(2)拜耳靶向抗癌药Vitrakvi(larotrectinib),2018年获批治疗NTRK基因融合肿瘤。
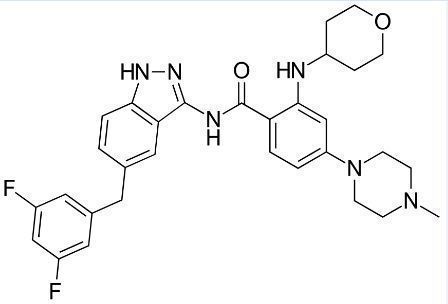
Rozlytrek活性药物对照entrectinib的分子结构(图片来源:Wikipedia)
Rozlytrek的活性药物成分为entrectinib,这是一种选择性酪氨酸激酶抑制剂(TKI),靶向治疗携带NTRK1/2/3(编码TRKA/TRKB/TRKC)或ROS1基因融合的局部晚期或转移性实体瘤。entrectinib可穿越血脑屏障,阻断TRKA/B/C和ROS1蛋白的激酶活性,导致携带ROS1或NTRK基因融合的癌细胞死亡。entrectinib针对原发性和转移性CNS疾病均具有疗效,并且没有不良的脱靶活性。目前,罗氏正在调查entrectinib治疗多种实体瘤的潜力,包括NSCLC、胰腺癌、肉瘤、甲状腺癌、涎腺癌、胃肠道间质瘤和未知原发癌(CUP)。
(责任编辑:香港祺昌药业)
联系祺昌
24小时服务热线:(086)150 1799 1962 / (086)189 2841 1962



