基石药业合作伙伴Blueprint Medicines近日宣布,已向美国食品和药物管理局(FDA)提交了pralsetinib的新药申请(NDA),用于治疗晚期或转移性RET突变甲状腺髓样癌(MTC)患者和RET融合阳性甲状腺癌患者。注:pralsetinib由Blueprint Medicines设计,这是一种口服、强效、高选择性的RET融合和突变(包括预测的耐药突变)抑制剂。
此次新药申请(NDA),通过实时肿瘤学审查试点项目(RTOR项目)提交。这是FDA肿瘤卓越中心推出的一项倡议,旨在探索一种更有效的审查程序,以确保患者尽快获得安全有效的治疗药物,同时保持和提高FDA的审查质量。
今年5月,pralsetinib治疗局部晚期或转移性RET融合阳性非小细胞肺癌(NSCLC)的新药申请(NDA)和营销授权申请(MAA)分别被FDA和欧洲药品管理局(EMA)受理。
Blueprint Medicines首席医学官Andy Boral表示:“preliminary具有广泛的潜力来满足携带RET基因改变的癌症患者的医疗需求,尽管其肿瘤有已知的疾病驱动因素,但在传统上并没有从靶向治疗中获益。目前,pralsetinib在RET改变的非小细胞肺癌和甲状腺癌的上市申请正在接受审查。我们正与监管机构密切合作,尽快为患者提供这种有希望的治疗药物。”
转染期间重排(RET)基因是一个在转染过程中发生重排的原癌基因,并因此而得名,该基因编码一种细胞膜受体酪氨酸激酶RET,其异常是多种类型肿瘤的罕见驱动因素。
RET激活型融合和突变是许多癌症类型的关键疾病驱动因素,包括NSCLC和MTC。RET融合涉及约1-2%的NSCLC患者、约10-20%的甲状腺乳头状癌(PTC)患者,而RET突变牵涉到约90%的晚期MTC患者。此外,在结直肠癌、乳腺癌、胰腺癌和其他癌症中,也观察到低频率的RET改变,在耐药、EGFR突变的NSCLC患者中也观察到RET融合。
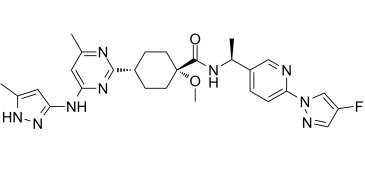
pralsetinib分子结构式(图片来源:medchemexpress.com)
pralsetinib是一种口服(每日一次)、高效和高选择性的靶向致癌性RET变异的精准药物。Blueprint Medicines正在进行pralsetinib的临床开发,用于治疗RET变异的非小细胞肺癌、甲状腺髓样癌和其他实体瘤患者。在美国,FDA已授予pralsetinib突破性疗法认定,用于治疗经含铂化疗进展的RET融合NSCLC、和需要系统治疗且没有可替代治疗方案的RET突变甲状腺髓样癌(MTC)患者的治疗。
pralsetinib是由Blueprint Medicines的研究团队依据其专有化合物文库所设计的。在临床前研究中,pralsetinib针对最常见RET基因融合、激活突变和耐药突变始终表现出次纳摩尔水平的效价。此外,pralsetinib对RET的选择性与已批准的多激酶抑制剂相比有显著提高,其中,对RET有效性与VEGFR2相比有超过90倍的提高。通过抑制原发和继发突变,pralsetinib有望克服和预防临床耐药性的发生。这种治疗方法预期可以在携带不同RET变异的患者中实现持久的临床缓解,且具有良好的安全性。
(责任编辑:香港祺昌药业)
联系祺昌
24小时服务热线:(086)198 9653 1862 / (086)189 2841 1962