7月11日,美国FDA批准AB-1005用于治疗中度帕金森病(PD)的快速通道指定。此外,AB-1005还获得了英国药品和保健品管理局(MHRA)授予的创新护照称号。
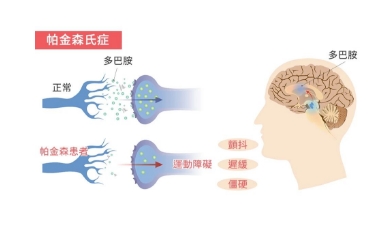
帕金森运动症状是由多巴胺能神经元的功能受损和最终丧失引起的,多巴胺能神经元是负责产生多巴胺的神经细胞。多巴胺是一种神经递质,在大脑的通讯网络中起着关键的作用,对控制随意运动至关重要。
左旋多巴是缓解其运动症状最常用的药物,旨在为身体提供一种细胞可以用来产生多巴胺的分子。然而,长期服用左旋多巴的患者可能会经历两次给药之间的症状没有完全控制的时期,称为停药期。
AB-1005,以前被称为AAV2-GDNF,是一种研究中的基因疗法,使用腺相关病毒2型(AAV2)载体将GDNF基因传递到目标大脑区域。这种疗法旨在刺激胶质细胞源性神经营养因子(GDNF)的产生和释放,这是一种对多巴胺能神经元的生存和功能至关重要的小蛋白。
该疗法通过核磁共振成像(MRI)引导的神经外科注射直接传递到壳核——一个参与运动控制的大脑区域。然后,目标脑细胞将使用传递的基因来持续产生GDNF,这有望缓解帕金森病人的运动症状。
该指定得到了一项为期18个月的1b期试验(ClinicalTrials.gov标识符:NCT04167540)数据的支持,该试验评估了11名帕金森病患者一次性双侧直接向壳核递送AB-1005的安全性和潜在临床效果。该研究包括2个队列:轻度阶段(n=6)和中度阶段(n=5)。
在轻度队列中,根据使用运动障碍协会统一帕金森病评定量表(MDS-UPDRS)第II部分患者报告的日常生活活动评分和第III部分临床医生评定的“开”和“停”用药状态下的运动检查评分进行的评估,从基线到18个月相对稳定。
结果显示,使用患者报告的PD运动日记,患者“良好”时间减少了1.3小时,“开机”时间增加了0.2小时,但有麻烦的运动障碍,“关机”时间增加了1.1小时。一名患者拒绝完成日记,一名患者患有病理意义不明的遗传缺陷。根据AskBio的说法,这些因素可能导致该组的结果恶化。
在中度队列中,在18个月时观察到MDS-UPDRS评分的改善,包括第II部分日常生活活动(比基线低3.8分)和第III部分运动检查(与基线相比,“停药”药物-20.4分,“开药”药物-10.6分)。使用运动日记,患者报告“良好”时间改善了2.2小时,“开机”时间减少了0.5小时,但有麻烦的运动障碍;“关机”时间减少了1.7小时。此外,还发现治疗后多巴胺药物的使用量有所减少。
研究结果显示,报告的大多数不良事件(AE)都是短暂性的,并且是围手术期事件(治疗后不到1个月);不良事件包括头痛、震颤、运动障碍、关节痛、肌肉骨骼胸痛、疲劳、COVID-19和磁共振成像MRI异常。报告了57例非严重不良事件和6例严重不良事件。
目前正在招募随机、双盲、手术控制的2期REGENERATE-PD试验(ClinicalTrials.gov 标识符:NCT06285643)的患者。该试验正在美国多个地点招募尽管接受稳定的药物治疗但仍然出现运动波动的45至75岁中度帕金森病患者,以评估AB-1005对这些患者的疗效和安全性。
(责任编辑:admin)
联系祺昌
24小时服务热线:(086)198 9653 1862 / (086)189 2841 1962