Blenrep(belantamab mafodotin)注射剂说明书
2020年8月5日,美国食品药品监督管理局(FDA)批准了葛兰素史克(GSK)公司的Blenrep(belantamab mafodotin,GSK2857916)上市。该药是一种靶向B细胞成熟抗原(BCMA)的抗体药物偶联物(ADC),作为一种单药疗法,用于治疗先前已接受过至少4种疗法、且其疾病对至少一种蛋白酶体抑制剂/免疫调节剂/CD38单抗难治、在最后一次治疗中被证明疾病进展的复发或难治性多发性骨髓瘤(R/R MM)成人患者。
葛兰素史克 GSK 公司生产的Blenrep图册
【生产企业】:葛兰素史克 GSK
【规格】:100mg/瓶
【商标】:BLENREP
【通用名】:belantamab mafodotin-blmf for injection
【英文名称】:BLENREP (belantamab mafodotin-blmf) for injection, for intravenous use
【贮藏】:冷藏于2°C至8°C
【Blenrep(belantamab mafodotin)注射剂适应症】
BLENREP用于成人复发性或难治性多发性骨髓瘤的治疗,这些患者以前至少接受过4种治疗,包括抗CD38单克隆抗体、蛋白酶体抑制剂和免疫调节剂。
根据肿瘤缓解率数据,该适应症通过加速审批程序获得批准。针对该适应症的持续批准,将取决于验证性试验中临床益处的验证和描述。
【Blenrep(belantamab mafodotin)注射剂剂量和给药方法】
1.重要安全信息
在Blenrep治疗开始前和治疗期间进行眼科检查
除非有眼科医生指导,建议患者使用不含防腐剂的眼药水并且避免佩戴隐形眼镜。
2.推荐剂量
BLENREP的推荐剂量为2.5mg/kg,每3周一次,静脉输注约30分钟,直到疾病进展或出现不可接受的毒性。
3.不良反应的剂量调整
不良反应的推荐剂量为1.9 mg/kg静脉滴注,每3周一次
不能耐受1.9 mg/kg剂量的患者停止使用BLENREP
4.角膜不良反应的剂量调整
|
|
角膜不良反应 |
推荐剂量 |
|
1级 |
角膜检查结果:轻度浅表性角膜病变
最佳矫正视力(BCVA)改变:Snellen视觉敏锐度下降1行 |
按当前剂量继续治疗。 |
|
2级 |
角膜检查结果:中度浅表性角膜病变
BCVA变化:Snellen视力下降2或3行且不低于20/200 |
停止使用BLENREP直至角膜检查结果均得到改善,并且BCVA变为1级或更高,并以相同剂量恢复。 |
|
3级 |
角膜检查结果:严重的浅表性角膜病变
BCVA的变化: Snellen视力比基线下降3行以上且不低于20/200 |
暂停使用BLENREP直至角膜检查结果均得到改善,并且BCVA更改为1级或更高,并以减少的剂量恢复。 |
|
4级 |
角膜检查结果:角膜上皮缺损
BCVA变化:Snellen视力低于20/200 |
考虑永久停用BLENREP。如果继续治疗,则暂不使用BLENREP,直到两个角膜检查结果均得到改善,并且BCVA变为1级或更高,并以减少的剂量恢复。 |
轻度浅表角膜病:有症状或无症状的轻度浅表性角膜病变(有记录在案的视力变化)
BCVA改变:与治疗相关的角膜病变引起的视力变化
中度浅表性角膜病变:有或没有斑块状的微囊样沉积物,眼睛上皮下混浊或新的周围基质不透明。
严重的浅表性角膜病变,伴有或不伴有弥散性微囊样沉积物,眼睛上皮下混浊新的中央基质混浊。
角膜上皮缺损:例如角膜溃疡 |
5.其他不良反应的剂量调整
|
不良反应 |
严重程度 |
推荐剂量 |
|
血小板减少症 |
血小板计数25,000至小于50,000 / mcL |
考虑停用BLENREP和/或减少BLENREP的剂量。 |
|
血小板计数低于25,000 / mcL |
暂停使用BLENREP,直到血小板计数提高到3级或更高。考虑以减少的剂量恢复。 |
|
输液相关反应 |
2级(中等)或3级(严重) |
中断输液并提供支持治疗。症状缓解后,以较低的输注速度恢复;将输注速度降低至少50%。 |
|
四级(危及生命) |
永久停止使用BLENREP并提供紧急护理。 |
|
其他不良反应 |
3级 |
暂停使用BLENREP,直到达到1级或更高。考虑以减少的剂量恢复。 |
|
|
4级 |
考虑永久停用BLENREP。如果继续治疗,则暂不使用BLENREP直至改善至1级或更高,然后以减少的剂量恢复。 |
【Blenrep(belantamab mafodotin)注射剂给药配制】
BLENREP是一种危险的药物。遵循适用的特殊处理和处置程序。
根据患者的实际体重计算所需溶液的剂量(Mg)、总体积(ML)和所需的BLENREP小瓶数量。一次剂量可能需要1瓶以上。不要舍去小瓶的剂量。
一、重构
1. 从冰箱中取出BLENREP小瓶,静置约10分钟以达到室温(20°C至25°C)。
2. 用2 mL无菌注射用水重构每个100 mg的BLENREP小瓶,使最终浓度为50 mg / mL。轻轻旋转小瓶以帮助溶解。不要摇晃。
3. 如果不立即使用重构溶液,请在2°C至8°C下冷藏保存或在室温(20°C至25°C)中最多放置4个小时。如果未在4小时内使用,请丢弃溶液。不要冻结。
4. 在给药前应目视检药品是否有颗粒物质和变色。重构后的溶液应透明至乳白色,无色至黄色至棕色液体。如果发现异物,则丢弃。
二、稀释
从适当数量的小瓶中取出计算出的BLENREP的体积,并在含有250 mL的0.9%氯化钠注射液输液袋中稀释至0.2 mg / mL至2 mg / mL的最终浓度。输液袋必须由聚氯乙烯(PVC)或聚烯烃(PO)制成。
轻轻颠倒混合稀释后的溶液。不要摇晃。
丢弃小瓶中残留的任何未使用的BLENREP重构溶液。
如果不立即使用稀释的输液,请在2°C至8°C的温度下冷藏保存至多24小时。不要冻结。从冰箱中取出后,请在6小时内(包括输注时间)使用BLENREP的稀释输注溶液。
在给药前应目视检药品是否有颗粒物质和变色。稀释后的输注溶液应透明无色。如果发现有颗粒物,则丢弃。
三、使用
如果冷藏,请在给药前将稀释的输注溶液放置至室温(20°C至25°C)。稀释的输注溶液可以在室温下保存不超过6小时(包括输注时间)。
使用聚氯乙烯(PVC)或聚烯烃(PO)制成的输液器,在大约30分钟内通过静脉输液进行给药。
无需过滤稀释溶液;如果要将稀释的溶液过滤,请使用聚醚砜(PES)过滤器(0.2微米)。
请勿将BLENREP与其他产品混合或混用。该产品不含防腐剂。
【Blenrep(belantamab mafodotin)注射剂的警告和注意事项】
1. 眼部毒性:可能会出现角膜病、视力改变等情况。建议患者每天至少使用4次不含防腐剂的眼药水。从第一次输液开始,一直持续到治疗结束。除非得到眼科医生的指导,否则不要使用隐形眼镜。视力的改变可能影响驾驶和阅读,建议病人在驾驶或操作机器时要小心。BLENREP仅通过REMS下的受限计划提供。
2. BLENREP REMS:由于眼部毒性的风险,BLENREP只能通过称为BLENREP REMS的REMS下的受限计划获得。
3. 血细胞计数减少。根据临床指示在基线和治疗期间进行完整的血细胞计数检查。根据严重程度考虑停药和/或减少剂量
4. 输液相关反应:监测患者输液相关反应。对于2级或3级反应,请中断输液并提供支持治疗。症状缓解后,以较低的输注速率恢复。之后在注射之前使用相应药物以减少不良反应发生。如果输液相关反应危及生命,立即停止使用并提供适当的紧急护理。
5. 胎儿毒性:根据其作用机制,BLENREP在给孕妇使用时会造成胎儿伤害,因为它含有一种遗传毒性化合物(微管抑制剂,单甲基金黄色F[MMAF]),而且它的靶标是活跃的分裂细胞。建议孕妇注意胎儿的潜在危险。劝告有生育潜力的女性在BLENREP治疗期间以及最后一次用药后的4个月内使用有效的避孕方法。建议具有生殖潜能的女性伴侣的男性在BLENREP治疗期间以及最后一次给药后的6个月内使用有效的避孕药
【Blenrep(belantamab mafodotin)注射剂药物过量】
暂无有关信息
【Blenrep(belantamab mafodotin)注射剂禁忌症】
无
【Blenrep(belantamab mafodotin)注射剂不良反应】
最常见的不良反应(≥20%)是角膜病变(眼睛检查时角膜上皮细胞改变)、视力下降、恶心、视力模糊、发热、输液相关反应和疲劳。
最常见的3级或4级实验室异常(≥5%)是血小板减少、淋巴细胞减少、血红蛋白减少、中性粒细胞减少、肌酐升高和γ-谷氨酰转移酶升高。
【Blenrep(belantamab mafodotin)注射剂在特殊人群中使用】
孕妇:BLENREP可能会造成胎儿伤害,在使用BLENREP治疗期间和末次剂量后4个月内使用有效的避孕措施。
哺乳期:劝告妇女在使用BLENREP治疗期间以及最终剂量后至少3个月内不要母乳喂养
儿童:在儿科患者中安全性和有效性尚未确定。
【Blenrep(belantamab mafodotin)注射剂一般描述】
Belantamab mafodotin-blmf是一种B细胞成熟抗原(BCMA)导向的抗体和微管抑制剂结合物,由3个组分组成:1)糖基化的人源化免疫球蛋白G1单克隆抗体通过3)抗蛋白酶的马来酰亚胺丙基连接物与2)微管抑制剂MMAF共价连接。该抗体是利用重组DNA技术在哺乳动物细胞系(中国仓鼠卵巢)中生产的,微管抑制剂和连接物是通过化学合成的。大约每个抗体分子上附着4个mafodotin分子。Belantamab mafodotin-blmf的分子量约为152 kDa。Belantamab mafodotin-blmf具有以下结构
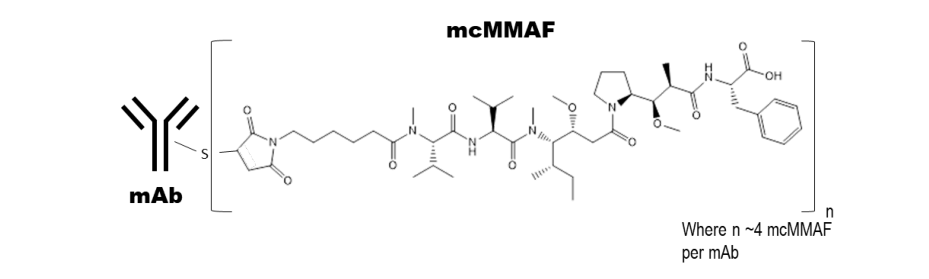
注射用BLENREP(belantamab mafodotin-blmf)是一种无菌、无防腐剂、白色到黄色的冻干粉,装在单量剂瓶中,用于静脉注射前的重新配置和进一步稀释。BLENREP每瓶100mg,需要用2mL注射用无菌水重新配制,以获得50mg/mL的浓度。每mL重组液含有Belantamab Mafodotin-BLMF(50 mg)和非活性成分柠檬酸(0.4 mg)、依地酸钠(0.019 mg)、聚山梨酸酯80(0.2 mg)、二水海藻糖(75.6 mg)和二水柠檬酸钠(6.7 mg)。重组溶液的pH值为6.2。
【Blenrep(belantamab mafodotin)注射剂作用机制】
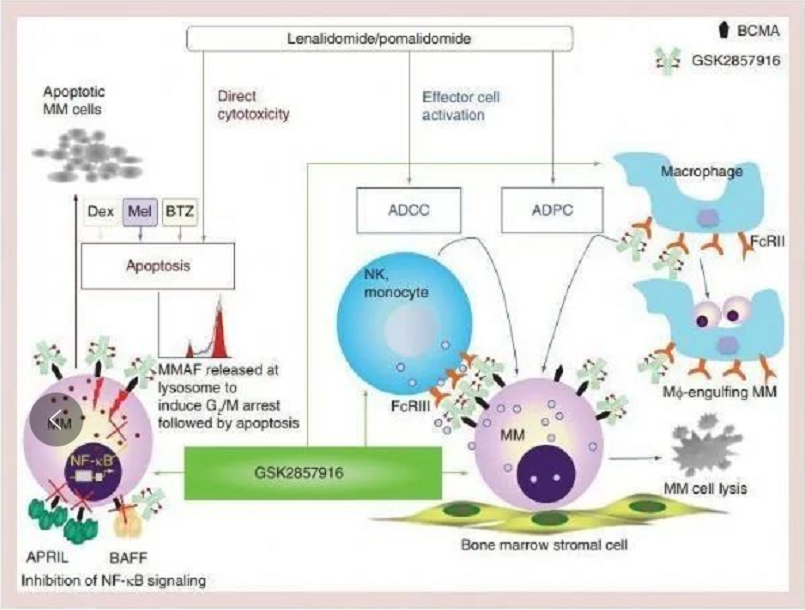
Belantamab mafodotin-blmf是一种抗体-药物结合物(ADC)。抗体成分是针对BCMA(一种在正常B淋巴细胞和多发性骨髓瘤细胞上表达的蛋白)的糖基化IgG1。小分子成分是微管抑制剂MMAF。当与BCMA结合时,belantamab mafodotin-blmf被内化,然后通过蛋白水解释放MMAF。释放的MMAF在细胞内破坏微管网络,导致细胞周期停滞和凋亡。Belantamab mafodotin-blmf对多发性骨髓瘤细胞具有抗肿瘤活性,可通过MMAF诱导的细胞凋亡、抗体依赖的细胞毒作用(ADCC)和抗体依赖的细胞吞噬作用(ADCP)介导对肿瘤细胞的杀伤作用。
【患者资讯资料】
1. 忠告患者出现以上任何不良反应(警告和注意事项)的症状立即联系医护人员。
2. BLENREP可能引起角膜上皮的变化,导致视力变化,包括严重的视力丧失和角膜溃疡,以及症状,如视力模糊和干眼
3. 在每次给药之前,在基线进行眼科检查,并及时检查是否有恶化的症状。根据严重程度暂停使用BLENREP直到病情好转和恢复,或永久停止给药。
4. 由于眼部毒性的风险,BLENREP只能在风险评估和缓解策略(REMS)下通过一项名为BLENREP REMS的受限计划获得。
5. 告知妊娠妇女和生殖潜能妇女,BLENREP可能会造成胎儿伤害,在使用BLENREP治疗期间和末次剂量后4个月内使用有效的避孕措施。
6. 建议具有生殖潜能的女性伴侣的男性患者在接受BLENREP治疗期间以及最终剂量后6个月内使用有效的避孕方法。
7. 告知哺乳期妇女在接受BLENREP治疗期间及最终剂量后的3个月内不要母乳喂养。
8. 忠告患者应主动告知正在使用的其他任何药物,包括处方药、非处方药等。
(责任编辑:香港祺昌药业)
联系祺昌
24小时服务热线:(086)198 9653 1862 / (086)189 2841 1962




