吉利德科学(Gilead Sciences)近日宣布,美国食品和药物管理局(FDA)已授予magrolimab突破性药物资格(BTD),这是一种首创的抗CD47单克隆抗体,用于治疗新诊断的骨髓增生异常综合征(MDS)。

MDS是一种由骨髓中形成不良或功能失调的血细胞引起的癌症。在美国,每年约有15000人被诊断出MDS,14年来没有新的治疗方法被批准。低风险MDS患者的平均生存期为6年,高风险MDS患者约为18个月。
magrolimab是一款阻断CD47信号的单克隆抗体。magrolimab旨在干扰巨噬细胞上SIRPα受体对CD47的识别,从而阻断癌细胞使用“别吃我”信号避免被巨噬细胞吞噬。
magrolimab在一些血液学和实体瘤恶性肿瘤中进行了开发,包括MDS。之前,magrolimab已被FDA授予用于MDS、急性髓系白血病(AML)、弥漫性大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)的快速通道资格(FTD)。magrolimab还被FDA授予治疗MDS和AML孤儿药资格(ODD),并被欧洲药品管理局(EMA)授予了治疗AML的孤儿药资格。
根据正在进行的1b期研究的积极结果,FDA授予了magrolimab治疗MDS的突破性药物资格。该研究评估了magrolimab与阿扎胞苷联合治疗先前未经治疗的中、高、极高危MDS患者。在2020年欧洲血液学学会(EHS)大会上公布的数据显示,接受magrolimab与阿扎胞苷联合治疗的可评估患者(n=33)中,客观缓解率(ORR)高达91%,完全缓解率(CR)高达42%。magrolimab联合阿扎胞苷治疗的耐受性良好。没有达到最大耐受剂量,也没有MDS患者因治疗相关不良事件而停止治疗。
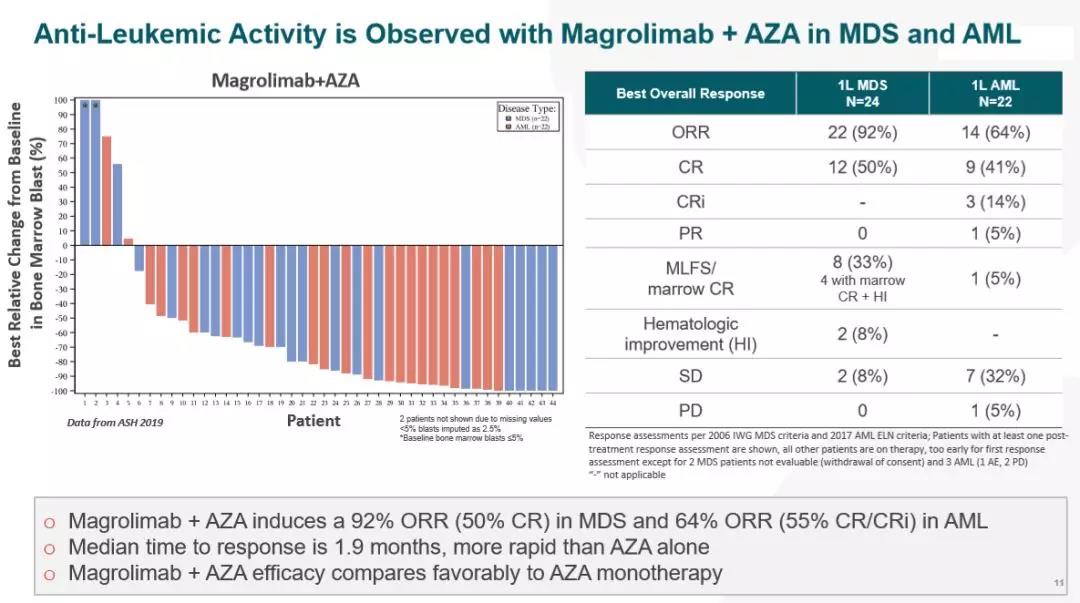
Magrolimab组合疗法治疗MDS和AML患者的早期临床表现
目前,magrolimab正在进行双盲、安慰剂对照、随机3期ENHANCE试验,用于先前未经治疗的高危MDS患者。该试验将通过CR和CR持续时间来评估magrolimab联合阿扎胞苷的安全性和有效性。
原文出处:Gilead’s Magrolimab, anInvestigational Anti-CD47 Monoclonal Antibody, Receives FDA BreakthroughTherapy Designation for Treatment of Myelodysplastic Syndrome
24小时服务热线:(086)150 1799 1962 / (086)189 2841 1962
