12月22日,美国FDA已经接受并优先审查patritumab deruxtecan (HER3-DXd)的生物制剂许可申请(BLA),用于治疗以前接受过两种或更多种全身治疗的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)的成年患者。
HER3是受体酪氨酸激酶EGFR家族的成员。据估计,约83%的原发性NSCLC肿瘤和90%的晚期EGFR突变肿瘤在既往EGFR TKI治疗后表达HER3。目前尚无HER3定向疗法被批准用于治疗任何癌症。
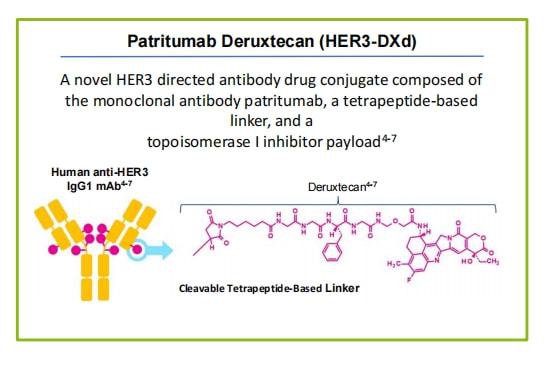
该药于2021年12月被、FDA授予突破性疗法认定,用于治疗接受第三代TKI和铂类疗法治疗期间或之后疾病进展的EGFR突变局部晚期或转移性NSCLC患者。Patritumab deruxtecan是一种潜在的一流HER3导向抗体药物偶联物,研究性治疗由全人源抗HER3 IgG1单克隆抗体组成,该抗体通过稳定的基于四肽的可裂解接头连接到拓扑异构酶I抑制剂有效负载(exatecan衍生物,DXd)。
如获批,patritumab deruxtecan将成为这些患者的第一个HER3导向的DXd抗体药物缀合物。
该申请得到了随机、开放标签、关键的2期HERTHENA-Lung01试验(ClinicalTrials.gov标识符:NCT04619004)数据的支持,该试验评估了在至少1种EGFR酪氨酸激酶抑制剂(TKI)和1种铂类化疗后疾病进展的225名患有EGFR突变的局部晚期或转移性非小细胞肺癌的成人中patritumab deruxtecan的抗肿瘤活性。研究参与者通过静脉输注接受5.6mg/kg固定剂量的patritumab deruxtecan方案。
结果显示,在接受固定剂量方案的患者中,确认的客观缓解率(主要终点)为29.8% (95% CI,23.9-36.2),其中1例患者达到完全缓解,66例达到部分缓解。中位缓解持续时间为6.4个月(95%可信区间为4.9-7.8)。
patritumab deruxtecan的安全性与之前1期试验中的安全性一致。最常见的治疗中出现的3级或以上不良事件为血小板减少症(21%)、中性粒细胞减少症(19%)、贫血(14%)、白细胞减少症(10%)、疲劳(6%)、低钾血症(5%)和乏力(5%)。
(责任编辑:admin)
联系祺昌
24小时服务热线:(086)198 9653 1862 / (086)189 2841 1962